Introducción
 Durante las últimas décadas ha habido en todo el mundo un enorme aumento de las tasas de infección por patógenos resistentes a múltiples fármacos, un reconocido problema de crisis de la salud pública. A menudo, el manejo de las infecciones causadas por estos patógenos es muy difícil debido a la escasez de fármacos activos disponibles.
Durante las últimas décadas ha habido en todo el mundo un enorme aumento de las tasas de infección por patógenos resistentes a múltiples fármacos, un reconocido problema de crisis de la salud pública. A menudo, el manejo de las infecciones causadas por estos patógenos es muy difícil debido a la escasez de fármacos activos disponibles.
El último informe de la red del European Antibiotical Resistence Surveillance System (Red Europea del Sistema de Vigilancia de la Resistencia Antibiótica), que incluye a 30 países europeos, describe un aumento general en toda Europa de la resistencia a los antimicrobianos de las bacterias Gram negativas que están bajo vigilancia (Escherichia coli, Klebsiella pneumoniae y Pseudomonas aeruginosa).
En muchos países europeos se han informado grandes proporciones de P. aeruginosa resistente a los antimicrobianos. En un estudio español realizado en 2000, el 41% de los aislados de Acinetobacter baumannii era resistente a los carbapenemes. De hecho, la tasa de resistencia al carbapenem ha aumentado notablemente en la última década, especialmente en los servicios de cuidados intensivos. Una nueva amenaza muy peligrosa es la aparición de microorganismos Gram negativos que poseen nuevas β lactamasas que les confieren una elevada resistencia a todas las clases disponibles de antibióticos β lactámicos.
En cuanto a las bacterias Gram positivas, los patógenos más problemáticos siguen siendo Staphylococcus aureus meticilina resistente (SAMR) y Enterococcus spp. vancomicina resistentes (EVR). La incidencia de infecciones por SAMR parece haber permanecido estable en los últimos años, a pesar de que este patógeno causa infecciones graves.
La creciente incidencia de SAMR en las unidades de cuidados intensivos (UCI) es claramente un problema más complejo, donde la presión de selección y la aparición de resistencia, así como el riesgo de transmisión de paciente a paciente son más elevadas.
El Spanish Annual April-to-June ICU National Nosocomial Infection Surveillance Study (Estudio Nacional de Vigilancia de la Infección Nosocomial [ENVIN]) confirma que la resistencia a múltiples fármacos es un problema no resuelto en las UCI españolas, con tasas preocupantes de patógenos Gram negativos resistentes a múltiples fármacos.
Por otra parte, los microorganismos multirresistentes no suelen causar infecciones verdaderas sino solamente colonización, lo que constituye un depósito oculto para la propagación de estos patógenos. Es importante destacar que una gran proporción de estos pacientes recibe tratamiento antimicrobiano.
El pronóstico de los pacientes que desarrollan infecciones nosocomiales en UCI es malo, especialmente si la infección es por un patógeno multirresistente. Las tasas de mortalidad y la carga económica son significativamente superiores en las infecciones causadas por patógenos resistentes a múltiples fármacos que en aquellas causadas por organismos sensibles. Por otra parte, incluso la adquisición de un patógeno multirresistente sin infección concomitante se asocia con un riesgo más elevado de muerte, duración de la hospitalización y costos.
Programas previos aplicados en las UCI españolas
La Sociedad Española de Medicina Intensiva y Unidad Coronaria (SEMICYUC) y la Sociedad Española de Enfermería de Cuidados Intensivos (SEECI) recientemente han finalizado su papel de líderes técnicos de 2 programas destinados a reducir las infecciones adquiridas en UCI, uno para las infecciones del torrente sanguíneo relacionadas con el catéter ("Bacteriemia Cero") y el otro, para la neumonía asociada a la ventilación mecánica (NAVM) (“NAVM Cero”).
Ambos proyectos, promovidos por el Ministerio de Salud español, se desarrollaron dentro de un marco de "tolerancia cero” y participaron más de 200 UCI. Los programas consistieron en la prevención de las infecciones del torrente sanguíneo relacionadas con el catéter y la NAVM. La obtención de resultados muy exitosos de ambas iniciativas ha confirmado que estas prácticas podrían ser implementadas sistemáticamente en España y reducir las tasas de estas infecciones y contribuir a disminuir el uso de antimicrobianos en las UCI participantes.
Metodología de "Resistencia Cero"
Con la experiencia adquirida de los dos proyectos previos, SEMICYUC ha desarrollado un nuevo proyecto denominado "Resistencia Cero", con el apoyo del Ministerio de Salud español. Este proyecto utiliza la misma estructura creada para "Bacteriemia Cero" y “NAVM Cero", la cual se basa en la coordinación en el nivel nacional, regional y local. Un Comité de Expertos Científicos (CEC) para el desarrollo y la implementación de este programa fue designado de la siguiente manera: SEMICYUC eligió a 9 intensivistas expertos en el campo de la prevención y el manejo de las infecciones en UCI y SEEIC designó a 1 enfermera de UCI con experiencia en el control de la infección. También se incorporaron un microbiólogo, un epidemiólogo, un especialista en enfermedades infecciosas y dos técnicos del Ministerio de Salud, con amplio conocimiento en ese campo.
Los miembros del CEC revisaron las pruebas disponibles en PubMed, incluyendo estudios de observación, ensayos clínicos, guías, revisiones sistemáticas y metaanálisis de diversas y reconocidas fuentes.
Para reducir la incidencia de bacteriemia relacionada con el catéter o las infecciones relacionadas con el ventilador se propuso la implementación de "paquetes" de medidas eficaces, a diferencia de las intervenciones individuales. Guiado por este concepto, el CEC desarrolló un conjunto de 10 recomendaciones que fueron debatidas y aprobadas después de la revisión y el análisis de la literatura científica existente. Es cierto que las evidencias que apoyan algunas de las recomendaciones elegidas son débiles, pero fueron consideradas en su totalidad para alcanzar al menos el nivel de “Recomendación de expertos”. No se utilizó ningún sistema de clasificación para apoyar la fuerza y la calidad de las recomendaciones. Todos los artículos incluyen comentarios destinados a facilitar las adaptaciones locales.
Los criterios para definir los patógenos multirresistentes varían de una institución a otra y tampoco son uniformes en la literatura publicada, aunque las cepas más resistentes son fácilmente reconocibles. Sobre la base de los patógenos considerados más problemáticos en las UCI españolas, "Resistencia Cero" recoge información sobre los episodios de infección y colonización de los patógenos que figuran en la siguiente tabla:
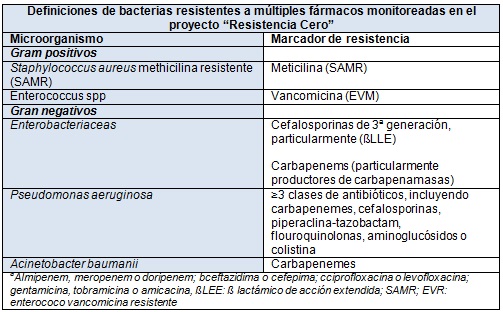
Finalmente, debido a que la adquisición de una infección puede ser el resultado de errores en el cuidado del paciente, los 3 programas fueron diseñados para reducir y prevenir las infecciones mediante la incorporación de un programa integral de seguridad para el paciente.
Objetivos
El objetivo principal del proyecto "Resistencia Cero " es reducir un 20% la incidencia acumulada de pacientes con infecciones por patógenos multirresistentes adquiridos en UCI. Los objetivos secundarios son el estudio de la epidemiología de las infecciones resistentes a múltiples fármacos en las UCI españolas, para poder distinguir los casos importados de los adquiridos y así promover y fortalecer con precisión la seguridad en las unidades participantes y, crear una red de UCI seguras, con prácticas basadas en la evidencia. El programa "Resistencia Cero" está activo desde abril de 2014.
Los “paquetes”
El objetivo principal de las recomendaciones de “paquetes” es reducir los 3 factores más influyentes en el desarrollo y la transmisión de la resistencia a múltiples fáarmacos:
1) la prescripción adecuada de antibióticos
2) la detección temprana y la prevención de la colonización cruzada de patógenos multirresistentes
3) la eliminación de los reservorios.
1.Primera recomendación: en cada UCI se designará al menos un intensivista responsable de la utilización de los antimicrobianos. Debe tener una amplia experiencia en el control de las infecciones y el tratamiento de las infecciones graves. Este médico o equipo médico debe evaluar sistemáticamente la prescripción de antimicrobianos y asesorar y asistir a los clínicos. El análisis de la prescripción de antimicrobianos debe incluir:
a) la revisión de la indicación de los antimicrobianos.
b) la evaluación de lo apropiado del antimicrobiano elegido y de su correcta administración (dosis, intervalos y duración).
c) la evaluación de la disminución de los antimicrobianos o incluso de su suspensión.
Justificación: la prescripción de antibióticos en el ámbito de la atención crítica es una tarea compleja que requiere un conocimiento profundo y extenso. Por otra parte, la farmacocinética y farmacodinámica de los antimicrobianos se ven afectadas por muchos cambios fisiopatológicos asociados a la enfermedad aguda grave o la sepsis, como la fuga capilar, el tercer espacio, el aumento del volumen de distribución y la alteración de la función renal y/o hepática.
Por lo tanto, es muy importante identificar a los intensivistas con un profundo conocimiento de las enfermedades infecciosas en los pacientes en estado crítico, con el fin de mejorar la calidad de la prescripción. Esto implica la elección óptima empírica de los antibióticos, su mejor modo de administración y la dosis correcta.
A menudo, la administración de antimicrobianos a los pacientes gravemente enfermos, con dosis definidas en estudios realizados en voluntarios sanos, logra solo concentraciones séricas subóptimas, lo que lleva al fracaso terapéutico y al desarrollo de resistencia.
La terapia antimicrobiana inmediata y adecuada reduce la morbilidad y la mortalidad en la sepsis grave y el shock séptico. Sin embargo, el tratamiento empírico debe ser adaptado tan pronto como la información microbiológica esté disponible, ya sea reduciendo el número de antimicrobianos o su espectro. No obstante, muchos médicos son reacios a retirar los antimicrobianos si el paciente está mejorando. De hecho, la disminución de la terapia empírica se realiza en menos de 50% de los pacientes. Estudios recientes han demostrado que la reducción es segura incluso en los pacientes críticamente enfermos con sepsis grave o inmunosupresión.
2.Segunda recomendación: administrar empíricamente antimicrobianos activos contra patógenos multirresistentes solo en los casos de sepsis grave o shock séptico y alto riesgo de patógenos multirresistentes, según los factores de riesgo del paciente y/o el conocimiento de la ecología local. De lo contrario, se recomiendan los antimicrobianos de espectro reducido o abstenerse de su uso hasta haber recibido los resultados microbiológicos e iniciar, si es necesario, los antibióticos activos contra los patógenos muultirresistentes (carbapenemes, colistina, tigeciclina, glucopéptidos, daptomicina, linezolida). En todos los casos, antes de iniciar la terapia antibiótica se deben obtener muestras para cultivo de las posibles fuentes de infección.
Justificación: en los pacientes con sepsis grave y shock séptico, el tratamiento antimicrobiano precoz y adecuado se asocia con mayor supervivencia. No obstante, se ha demostrado que el retraso de la terapia antimicrobiana hasta contar con la confirmación microbiológica se asocia con resultados similares a los de los pacientes quirúrgicos febriles internados en la UCI, comparado con el inicio de los antimicrobianos inmediatamente después del diagnóstico clínico de infección.
Más recientemente, un estudio de cohortes, de observación, cuasi experimental, de antes y después, concluyó que después del ajuste por los factores de error, la antibioticoterapia agresiva fue un predictor independiente de mortalidad. En el período agresivo, siempre el tratamiento antimicrobiano ha sido iniciado en los pacientes con sospecha de infección, a quienes después se les hicieron los cultivos apropiados. En el segundo periodo (estrategia conservadora), el tratamiento antimicrobiano ha sido iniciado solo después de haberse confirmado los signos objetivos de infección. La principal limitación de ambos estudios es que se hicieron en pacientes quirúrgicos y con escasos datos de las unidades médicas.
Sin embargo, es importante tener en cuenta que en los pacientes febriles con sepsis grave o shock séptico, el retraso en la terapia antimicrobiana puede ser fatal. Por otra parte, la elección de la antibioticoterapia empírica debe estar basada en un conocimiento actualizado de la ecología local. Por lo tanto, parece prudente recomendar el inicio de la terapia empírica inmediata con antibióticos activos contra patógenos multirresistentes solamente en los casos que cumplen con los criterios de sepsis grave o shock séptico y factores de riesgo para patógenos resistentes a múltiples fármacos.
Obviamente, es muy apropiado esforzarse para que los resultados microbiológicos se reciban con mayor rapidez (uso de técnicas de diagnóstico rápidas, contacto directo con el microbiólogo ...) y hacer un seguimiento cercano de la evolución clínica para detectar con rapidez los signos de alarma.
3.Tercera recomendación: en cada unidad se designará como líder de este proyecto al menos a 1 enfermera, responsable de las medidas de control de las infecciones destinadas a reducir la transmisión de patógenos resistentes a múltiples fármacos.
Justificación: El éxito de los programas de control de calidad depende particularmente de la participación de todas las categorías de profesionales de la salud. Las enfermeras representan un papel fundamental en la prevención y control de las enfermedades infecciosas y las medidas para prevenir la transmisión de paciente a paciente, ya que son un componente importante de la atención.
Es necesaria la intervención de un equipo multidisciplinario para desarrollar e implementar estrategias para prevenir la infección en el paciente crítico. La participación de las enfermeras es de extraordinaria importancia para el éxito de los programas de control de las infecciones en UCI. De hecho, la mayoría de los procedimientos realizados para reducir el riesgo de infección nosocomial (cuidado del catéter vascular, cuidado de la vía aérea artificial, higiene bucal, etc.) son parte de las tareas diarias de la enfermera. Los programas que han logrado reducir significativamente las tasas de infección nosocomial han designado al menos 1 médico y 1 enfermera en cada UCI como jefes de equipo.
Este modelo también ha sido implementado por programas exitosos diseñados para reducir las tasas de infección nosocomial en las UCI, aprobados por SEMICYUC. El programa “Resistencia Cero” apoya claramente la designación de un líder de enfermería en todas las UCI responsable del control de la infección, con el fin de reducir las infecciones nosocomiales y la transmisión de patógenos resistentes a múltiples fármacos.
4. Cuarta recomendación: se recomienda buscar activamente a los patógenos resistentes a múltiples fármacos en todos los pacientes a su ingreso en la UCI y al menos una vez por semana durante toda su internación. Las muestras serán procesadas para identificar a los agentes patógenos resistentes a múltiples fármacos según la epidemiología local y en colaboración con el Servicio de Microbiología y Control de Infecciones del equipo de cada hospital.
Justificación: Las guías para los organismos resistentes a múltiples fármacos incluyen recomendaciones para los cultivos de rutina y las precauciones de contacto para los pacientes después de su ingreso en unidades de alto riesgo como las UCI. La implementación de las precauciones de contacto en los pacientes colonizados o infectados con patógenos multirresistentes tiene una gran aceptación.
En contraste, la vigilancia sistemática de a resistencia a múltiple fármacos mediante cultivos todavía es un tema de debate y no ampliamente realizada. El cribado inicial está especialmente recomendado para los SAMR, aunque se aplican los mismos principios y prácticas para los organismos Gram negativos resistentes a múltiples fármacos, los que ahora constituyen la principal amenaza.
Los programas de vigilancia activa consumen tiempo y recursos. El tipo y número de muestras se seleccionan de acuerdo a los recursos y epidemiología locales y deben incluir al menos material del hisopado nasal, rectal y orofaríngeo (o el aspirado bronquial si el paciente está intubado). Por otra parte, las muestras pueden ser necesarias para controlar los reservorios potenciales (infecciones, úlceras cutáneas, etc.). En cuanto a los cultivos de vigilancia, se aceptan 2 enfoques. Se examina a todos los pacientes al ingresar a la UCI o solamente a aquellos con al menos uno de los factores de riesgo incluidos en la lista de verificación (quinta recomendación).
5.Quinta recomendación: al ingresar el paciente a la UCI se debe completar una “lista de verificación” de factores de riesgo para identificar a aquellos con un riesgo elevado de ser portadores de patógenos multirresistentes. Los pacientes que presentan al menos 1 de los factores de riesgo deben ser sometidos a las medidas de precaución de contacto hasta recibir los resultados de los cultivos.
Justificación: Se han identificado varios factores de riesgo asociados al transporte de patógenos multirresistentes, al ingreso al hospital o a la UCI, siendo los más frecuentes:
a) el uso previo de antibióticos
b) la presencia de dispositivos invasivos
c) la coexistencia de enfermedades subyacentes.
Los pacientes con riesgo de neumonía nosocomial causada por patógenos resistentes a múltiples fármacos según los criterios de la American Thoracic Society y la Infectious Disease Society of America son aquellos con el antecedente de:
a) hospitalización ≥5 días
b) antibióticoterapia previa
c) hospitalizaciones previas
d) residencia en un hogar geriátrico o unidades de larga estancia
e) haber recibido terapia de infusión o diálisis crónica dentro de los 30 días
f) curación domiciliaria de sus heridas
g) tener algún familiar portador o infectado con un patógeno o, inmunosuprimido.
Sin embargo, en un estudio de evaluación prospectivo, aunque estos criterios tenían un valor predictivo negativo excelente (96%), su valor predictivo positivo fue bajo (18%) para la infección o la colonización con un patógeno multirresistente al ingreso en la UCI. En un estudio de casos y controles, la inmunosupresión no se asoció independientemente con las bacterias multirresistentes en la UCI.
En otros estudios se han identificado factores de riesgo para patógenos específicos como SAMR o A. baumannii se, en un intento de establecer las medidas de control que limiten su propagación. Este enfoque está especialmente indicado en las UCI donde la mayoría de los episodios de colonización/infección están provocados por un microorganismo particular. Con esta información, el CEC generó una Lista de Control para detectar a los pacientes con un riesgo elevado de patógenos resistentes a múltiples fármacos.
Ante la presencia de ≥1 de estos factores de riesgo se impone el cribado al ingreso en la UCI mediante cultivos, al tiempo que el paciente debe ser puesto en aislamiento de contacto hasta recibir los resultados del cultivo negativos para los organismos objetivo. Una de las tareas pendientes de este programa es la validación prospectiva de esta lista de verificación.
Lista de verificación de los factores de riesgo para el transporte de las bacterias resistentes a múltiples fármacos

6.Sexta recomendación: se debe medir sistemáticamente el cumplimiento de las medidas preventivas, incluidas aquellas basadas en los mecanismos de transmisión.
Justificación: el soporte principal para reducir la transmisión de microorganismos son las medidas de contacto e higiene de las manos. El cumplimiento de estas prácticas debe ser reforzado y supervisarse continuamente.
Brevemente, las precauciones de contacto (para el personal y los visitantes) consisten en:
a) higiene de las manos.
b) colocación de bata y guantes inmediatamente antes de ingresar a la habitación.
c) la eliminación de la bata y los guantes en el interior de la habitación del paciente
d) la higiene inmediata de las manos, antes de salir de la habitación.
En un estudio, las tasas de adherencia a las precauciones de contacto en las UCI con disponibilidad en todas las instalaciones fueron del 75% y el 80%.
La práctica correcta incluye:
(1) Usar signos de precauciones de contacto para todos los pacientes colonizados/infectados por patógenos multirresistentes.
(2) Disponer del equipo para las precauciones de contacto a la entrada de la habitación del paciente
(3) Poner recipientes para la eliminación de las barreras dentro de la habitación del paciente.
(4) Hacer el seguimiento de la adhesión al protocolo de las precauciones de contacto por parte del personal y los visitantes.
Si no hay habitaciones cerradas, se deben estrechar las precauciones. Para lograr los resultados deseados, todos los miembros del personal deben dar cumplimiento a las medidas preventivas. Con respecto a este tema, para el programa "Resistencia Cero" el CEC considera que las enfermeras tienen una responsabilidad especial en la implementación de la prevención efectiva. Por lo tanto, el resto del personal del hospital y los visitantes deben seguir sus recomendaciones.
7.Séptima recomendación: Todas las unidades deben desarrollar un protocolo de limpieza para las habitaciones de los pacientes con patógenos multirresistentes.
Justificación: muchos brotes publicados de patógenos multirresistentes tienen una fuente común en superficies ambientales y áreas húmedas. Los estudios han documentado una deficiencia generalizada en las prácticas de limpieza. Sin embargo, se pueden lograr mejoras importantes en la limpieza y la desinfección aplicando los protocolos estandarizados en la UCI.
Los procedimientos de limpieza deben adaptarse a las características arquitectónicas de cada unidad y acordados con el personal de limpieza y el comité nosocomial para el control de las infecciones. Para mantener los beneficios es importante la retroalimentación informativa para todo el personal involucrado. Este protocolo debe incluir las estructuras fijas(suelos y paredes) así como la cama (Incluida la estructura principal, rieles y colchones). Los protocolos de limpieza incluirán la limpieza diaria y la limpieza final cuando el paciente es dado de alta de la unidad.
Los protocolos de limpieza de las habitaciones ocupadas por pacientes con patógenos multirresistentes deben especificar la metodología y la frecuencia de los productos de limpieza y desinfección, porque en el protocolo de cada hospital hay diferentes productos de limpieza aprobados, y en cada protocolo se debe especificar la composición exacta del producto o la marca comercial. Si se considera necesario, se establecerán controles para garantizar la erradicación del patógeno multirresistente.
8.Octava recomendación: es necesario tener disponible y actualizado un archivo o documento que especifiquen el equipo existente en la UCI y sus respectivos protocolos de limpieza.
Justificación: cualquier equipo de clínica o tecnológico podría actuar como un depósito microbiológico de patógenos multirresistentes. Por lo tanto, la primera acción es eliminar todos los materiales de consumo, dejando las superficies de trabajo tan libres como sea posible. El equipo debe estar presentado e informado sobre los siguientes aspectos: equipo responsable de la limpieza; horario de la limpieza y metodología de la limpieza (desinfección, esterilización). Cada trabajador de la salud es responsable de la limpieza y la desinfección de los equipos para uso personal (estetoscopios, linternas ...).
9. Novena recomendación: si los pacientes ya están colonizados o infectados con patógenos resistentes a múltiples fármacos, usar productos conteniendo clorhexidina al 4% para la higiene diaria de los pacientes.
Justificación: Varios estudios de observación y ensayos realizados en un solo centro han concluido que el baño diario de los pacientes ingresados en la UCI con clorhexidina reduce la adquisición de patógenos resistentes a múltiples fármacos y la incidencia de ciertas infecciones. Una revisión sistemática concluyó que el lavado del cuerpo con clorhexidina puede ser eficaz para prevenir el trasporte y posiblemente las infecciones del torrente sanguíneo con patógenos Gram positivos resistentes a múltiples fármacos, SAMR y EVR, mientras que la evidencia de que esta intervención erradica el trasporte o previene la infección por patógenos Gram negativos resistentes a múltiples fármacos es débil.
En un ensayo multicéntrico aleatorizado reciente realizado en 13 UCI se evaluó el efecto de diferentes estrategias para el control de la adquisición de infecciones por patógenos muultirresistentes. El mejoramiento de la higiene extendiendo el lavado de las manos con clorhexidina a zonas más extensas del cuerpo reduce la adquisición de patógenos, particularmente de SAMR. Llama la atención que en el contexto de un elevado grado de cumplimiento del lavado de manos y el baño con clorhexidina, la detección y el aislamiento de los portadores no redujo las tasas de adquisición de los patógenos resistentes a múltiples fármacos.
Más recientemente, un estudio multicéntrico abierto, cruzado, documentó los beneficios clínicos del baño diario con paños impregnados de clorhexidina, que redujo el riesgo de desarrollar bacteriemia multirresistente adquirida en el hospital.
Las soluciones de clorhexidina deben contener 0,16 gr. de clorhexidina (digluconato) (disolver clorhexidina al 4% en 1 litro de agua tibia). Se deben tener en cuenta las contraindicaciones y reacciones adversas de la clorhexidina.
Debido a que se trata de una molécula catiónica, su actividad puede estar reducida por los jabones naturales, diversos aniones inorgánicos, tensioactivos no iónicos y cremas para las manos que contienen agentes emulsionantes aniónicos. El baño diario con clorhexidina es fácil de implementar y relativamente barato, pudiendo ser una intervención adyuvante importante de las precauciones de barrera para reducir la adquisición y el desarrollo de infecciones.
10. Décima recomendación: ante la se sospecha de un brote, se recomienda identificar al microorganismo causal mediante métodos de caracterización molecular.
Justificación: Los estudios de los brotes según las características fenotípicas de los microorganismos (propiedades antigénicas, metabólicas o resistencia antibiótica) son pocos y no proporcionan diferencias o similitudes concluyentes entre ellos. Por consiguiente, se deben hacer métodos de caracterización molecular que puedan reconocer la vinculación epidemiológica entre los aislados derivados de un microorganismo precursor común. Esto también permite conocer el mecanismo de transmisión y difusión y diseñar estrategias de control y erradicación de la epidemia.
El programa "Resistencia Cero" estimula a los hospitales sin recursos a enviar los aislados de patógenos multirresistentes a un laboratorio de referencia (Centro Nacional de Microbiología, Instituto de Salud Carlos III) para hacer pruebas moleculares, donde la prueba microbiológica será realizada en forma gratuita.
Aplicación del programa "Resistencia Cero"
La aplicación activa de este programa es claramente necesaria para lograr los resultados deseados. Los autores informan que la Agencia para la Garantía de Calidad del Ministerio de Salud español promoverá su aplicación en colaboración con las 17 Autoridades Regionales de Atención de la Salud a través de la difusión, la coordinación y el seguimiento.
Cada comunidad autónoma creará un equipo de coordinación dirigido por un intensivista responsable de contactarse con los directivos del hospital. La dirección del hospital notificará la infección local y los comités de garantía de calidad para el paciente, y nombrará un equipo de coordinación local consistente en al menos 1 intensivista y 1 enfermera de cuidados intensivos. Se deberán proporcionar los recursos necesarios para ejecutar el proyecto.
El programa "Resistencia Cero" incluye un módulo de enseñanza basado en la web. Se recomienda que el equipo local lleve un registro del número de trabajadores de la salud, médicos, enfermeras y auxiliares de enfermería que integran el módulo de formación basado en la web e informe de sus índices educativos locales al coordinador regional. Estos datos están disponibles en la página web educativa.
Evaluación del impacto del proyecto "Resistencia Cero"
El impacto del proyecto "Resistencia Cero", como en todos los programas de calidad, debe ser medido mediante indicadores de calidad que pueden ser desglosados en estructura, procedimientos e indicadores de resultados. Obviamente, dicen los autores, las medidas de los resultados son de gran interés ya que reflejan todos los aspectos de la atención y son el objetivo final de la intervención.
Los indicadores propuestos se explican detalladamente en el programa, pero cada equipo local debe elegir cuáles son los indicadores que usarán para monitorear la función de los sistemas de información y los esfuerzos necesarios para obtener estas mediciones. Las UCI participantes en el programa "Resistencia Cero" se han comprometido a introducir los datos necesarios para el cálculo de los índices importantes, en el registro "ENVINADAS-HELICS" de la web. Los datos de "Resistencia Cero" se registran a través de una adaptación específica del "ENVINADAS-HELICS". Los coordinadores registran los datos de cada paciente. En resumen, la descripción estadística está disponible on line para cada unidad individual, y se puede acceder directamente a los datos actualizados a diario. Los resultados locales se muestran junto con los valores regionales y nacionales correspondientes.
Conclusión
La resistencia bacteriana a los antibióticos está creciendo día a día, sobre todo en los hospitales, con un impacto significativo en la mortalidad y la morbilidad. La falta de antibióticos nuevos, especialmente para los patógenos Gram negativos multirresistentes, empeora este grave problema.
A menudo, los antibióticos se prescriben en forma incorrecta siendo lo más frecuente:
a) el uso de antibióticos inadecuados.
b) la indicación de dosis incorrectas para una infección particular.
c) la administración de antibióticos para infecciones no bacterianas.
d) un tratamiento excesivamente prolongado.
"Resistencia Cero" es un proyecto desarrollado por SEMICYUC con el apoyo técnico del Ministerio de Salud español, con el objetivo principal de reducir en un 20% la incidencia acumulada de pacientes con multirresistencia bacteriana adquirida en la UCI. Este proyecto contiene un conjunto de 10 recomendaciones destinadas a mejorar la prescripción de antibióticos, la detección y la prevención de la colonización cruzada de patógenos multirresistentes y la eliminación de los reservorios. Esta iniciativa incluye un programa de seguridad integral del paciente y módulos educativos para facilitar su aplicación. La adherencia al proyecto y sus resultados serán evaluados a través de una serie de indicadores.
Fuente: Hospital Vírgen del Rocío, Sevilla; Hospital del Mar, Barcelona; Hospital La Fé, Valencia;Hospital Arnau de Vilanova, Lérida;Complejo Hospitalario La Coruña, La Coruña; Hospital de Fuenlabrada, Fuenlabrada, Madrid; Hospital Doce de Octubre, Madrid; Hospital Parc Taulí, Sabadell, Barcelona; Hospital Vírgen Macarena, Sevilla; Centro Nacional de Microbiología, Majadahonda, Madrid; Hospital Ramón y Cajal, Madrid; Ministerio de Salud, Madrid; Clínica San Carlos, Madrid.
Cita: José Garnacho Montero, Francisco Álvarez Lerma, Paula Ramírez Galleymore, Mercedes Palomar Martínez, Luis Álvarez Rocha, Fernando Barcenilla Gaite, Joaquín Álvarez Rodríguez6, Mercedes Catalán González, Inmaculada Fernández Moreno, Jesús Rodríguez Baño, José Campos, Jesús Ma Aranaz Andrés, Yolanda Agra Varela, Carolina Rodríguez Gay, Miguel Sánchez García y, The Scientific Expert Committee for the “Zero Resistance” Project. Combatting resistance in intensive care: the multimodal approach of the Spanish ICU “Zero Resistance” program. Montero et al. Critical Care (2015) 19: 114 Página 4 de 8.
Traducción y resumen objetivo: Dra. Marta Papponetti