Introducción
El comienzo temprano de la nutrición oral es promovido en la mayoría de los pacientes sometidos a cirugía colorrectal electiva y es un elemento importante de los protocolos de cirugía de vía rápida (fast-track) [1]. El comienzo temprano de la nutrición enteral, dentro de las primeras 24 horas del postoperatorio, es beneficioso e incluso se asocia con una tasa reducida de mortalidad, en comparación con la ausencia de ingesta calórica [2]. No obstante, ese abordaje temprano no es exitoso per se en todos los pacientes [1-3]. El comienzo temprano de la nutrición oral es comúnmente demorado después de una cirugía colorrectal mayor, por varios factores, incluyendo náusea y vómito postoperatorios [2].
El íleo postoperatorio (IPO) es una complicación común después de la cirugía abdominal y se acompaña de un aumento en la morbilidad del paciente, mayor uso de la nutrición parenteral, hospitalización prolongada y aumento de los costos [3,4]. Se considera que el origen del IPO es la manipulación de los intestinos, que lleva a una respuesta local inflamatoria [5].
Por lo tanto, la cirugía más extendida, se asocia frecuentemente con un riesgo más alto de IPO o retardo del vaciamiento gástrico. En el centro de referencia en donde se desempeñan los autores de este trabajo, se efectúan resecciones extensas para el cáncer rectal localmente avanzado. Un estudio retrospectivo hecho dentro de la institución mostró una alta incidencia de IPO; la omentoplastia realizada durante la cirugía rectal se asoció con un retardo en el vaciamiento gástrico y un retraso en la ingesta oral [3]. A una proporción considerable de esos pacientes se les brindó nutrición parenteral total para alcanzar las metas nutricionales, porque la nutrición oral a menudo fracasa durante la primera semana [3].
Los autores de este trabajo postularon que la nutrición enteral temprana (post-pilórica) podría ser beneficiosa después de una cirugía rectal mayor para reducir el IPO. Los efectos beneficiosos de la nutrición temprana por vía enteral podrían evitar el deterioro de la función gástrica, estimular la función intestinal, restaurar el movimiento intestinal y mejorar el resultado postoperatorio.
Métodos
Entre enero de 2009 y octubre de 2011, 123 pacientes sometidos a resección quirúrgica por carcinoma rectal primario o recidivado, fueron asignados randomizadamente para una nutrición enteral temprana (NET) suplementaria postoperatoria, o a una alimentación de control con nutrición parenteral temprana (NPT). Ambos grupos fueron estimulados para progresar a una nutrición oral.
Lineamiento del estudio
El protocolo del estudio fue aprobado por el comité de ética médica del Catharina Hospital Eindhoven, Holanda (METC n° M06-1682) y fue conducido por el Departamento de Cirugía y el Departamento de Cuidados Intensivos.
El estudio fue diseñado como un ensayo prospectivo, randomizado y controlado, de un único centro asistencial. Antes de la inclusión de los pacientes, en noviembre de 2008, el ensayo fue registrado en www.trialregister.nl (n° NTR1523).
El objetivo final primario fue definido como el tiempo (en días) para la primera defecación. Los objetivos secundarios fueron el resultado clínico, clasificación de Clavien-Dindo y duración de la estadía hospitalaria.
Población de pacientes
Los criterios de inclusión fueron la cirugía rectal electiva, tal como la resección anterior baja o la abdominoperineal, con o sin radioterapia intraoperatoria, para el carcinoma rectal primario o recurrente, aptitud para la cirugía electiva y consentimiento informado firmado preoperatoriamente.
Los criterios de exclusión fueron operaciones rectales de emergencia, resección hepática parcial simultánea, resección pulmonar o tratamiento quimioterápico intraperitoneal hipertérmico, presencia de várices esofágicas o antecedentes conocidos de hemorragia gástrica o esofágica.
La resección mesorrectal total, de acuerdo con el procedimiento descrito por Head y col. [6], fue efectuada rutinariamente durante el intervalo del estudio, con la excepción de la enfermedad localmente avanzada invadiendo la fascia mesorrectal. Se confeccionó una colostomía en asa de protección, en la mayoría de los pacientes sometidos a resección anterior baja con anastomosis (Tabla 1).
La mayoría (70%) recibió una omentoplastia para llenar la cavidad pélvica y/o proteger la anastomosis (Tabla 1). La radioterapia intraoperatoria fue aplicada al área de mayor riesgo de invasión del tumor, después de la evaluación histológica por congelación. Se brindó anestesia y analgesia estándar para ambos grupos.
• TABLA 1: Características basales (Ver tabla)
Intervenciones en el ensayo
Postoperatoriamente, se les permitió a todos los pacientes beber y comer tan pronto como fuera posible, de acuerdo con los protocolos estándar de atención. Dichos protocolos incluyeron beber agua el día de la cirugía y todos los líquidos al día siguiente, para progresar a una dieta normal sobre la base de la tolerancia.
A los pacientes randomizados para el grupo NET, se les colocó una sonda nasoyeyunal auto-migrante (Flocare Bengmark, Nutricia, Advanced Medical Nutrition, Zoetermeer, The Netherlands) y se les brindó alimentación enteral (Nutrison Protein Plus Multi Fibre, Nutricia, Advanced Medical Nutrition).
Se insertó la sonda nasoyeyunal preoperatoriamente, a cargo de la enfermera de guardia; sólo en caso de problemas con la colocación se la emplazó durante el procedimiento quirúrgico. La posición post-pilórica fue confirmada por el cirujano durante la operación o mediante una radiografía abdominal postoperatoria.
A los pacientes randomizados para el grupo NPT, se les colocó un catéter venoso central en la vena yugular después de la inducción anestésica, como parte del procedimiento estándar y recibieron nutrición parenteral (Kabiven Central enriquecida con Dipeptiven para asegurar un suplemento de la mejor calidad de aminoácidos; Fresenius Kabi Nederland BV,’s Hertogenbosch, The Netherlands).
El protocolo de alimentación para ambas rutas artificiales de nutrición fue el siguiente: en el día de la cirugía (día 0), 8 horas después de la terminación del procedimiento quirúrgico, se comenzó con la nutrición a 500 mL/24 hs. Al día siguiente (día 1 postoperatorio), a las 8 de la mañana, se aumentó la infusión continua a 1 L/24 hs; en el día 2, la infusión fue aumentada a 2 L/24 hs. La nutrición suplementaria artificial fue brindada durante los primeros 5 días postoperatorios, con la excepción de un retorno más rápido a la dieta oral normal dentro de los 3 días, reduciendo la nutrición suplementaria a 1 L. Las razones médicas, eventos adversos o deseos del paciente, que pudieran causar desvío del protocolo, fueron registrados.
Función gastrointestinal
Los registros diarios de ingesta, náusea, vómito y la presencia de la sonda nasogástrica o su reinserción dentro de los 5 días, retención gástrica y defecación, fueron obtenidos durante los primeros 5 días postoperatorios.
Para incluir más síntomas del IPO, que sólo el retorno de la defecación, los autores diseñaron otra definición más extensa del íleo. El IPO fue definido como temprano, tardío y prolongado.
Los pacientes tenían un íleo temprano si ocurría 1 o más de los siguientes síntomas: más de 1 episodio de náusea o vómito en los primeros 5 días postoperatorios, reinserción de la sonda nasogástrica en los primeros 5 días, presencia de la sonda nasogástrica por más de 4 días, no retorno a la dieta normal después de 5 días o primera defecación normal después de 7 días. El íleo tardío fue definido como nausea o vómito después de los primeros 5 días, influenciando la ingesta normal y la defecación, o la reinserción de la sonda nasogástrica.
Complicaciones
Se describieron las complicaciones quirúrgicas más comunes después de la cirugía rectal, tales como infección de la herida, abscesos intraabdominales o pélvicos, filtraciones anastomóticas, infección del tracto urinario, neumonía, bacteriemia e infección del catéter central y el número de reoperaciones o intervenciones percutáneas postoperatorias.
Un absceso intraabdominal o pelviano fue definido como un absceso diagnosticado por ecografía o tomografía computada (TC), requiriendo drenaje quirúrgico o percutáneo con la presencia de pus.
La filtración anastomótica fue definida como sospecha clínica de filtración de la anastomosis, confirmada por TC demostrando aire libre intraabdominal y fluidos en la proximidad cercana a la anastomosis, o una dehiscencia anastomótica visualizada en la reoperación. El número de filtraciones fue también sumado al número de abscesos para evitar el debate en la interpretación.
Una infección del catéter central fue definida como un cultivo positivo de un catéter central, combinado con un hemocultivo positivo.
Todas las complicaciones quirúrgicas fueron registradas y calificadas de acuerdo con Clavien y col. [7].
Randomización
Los pacientes fueron asignados al azar a 1 de ambos grupos del estudio, mediante un programa independiente externo de randomización en línea, generado por computadora (ALEA, NKI/AvL, The Netherland Cancer Institute, Biometrics Department, Amsterdam, The Netherlands). Para obtener grupos similares, se implementó estratificación por edad, sexo y esquema de radioterapia neoadyuvante (largo/corto).
Poder estadístico del análisis
Por medio del cálculo del poder estadístico, se asumió la superioridad del objetivo final primario (tiempo de la primera defecación) para la rama del tratamiento (nutrición enteral). Antes de iniciar el estudio, los datos retrospectivos mostraban un promedio de 6,6 ± 2,7 días hasta la primera defecación (n = 19, datos no publicados del hospital). Los autores apuntaron a reducir el número de días hasta la primera defecación a 3 días postoperatoriamente, usando la estimulación combinada oral y enteral del tracto gastrointestinal.
Con un intervalo de confianza (IC) del 95% (P < 0,05) y un poder mayor de 0,8, el tamaño de la muestra debería ser de 30 pacientes por grupo. En el análisis interino planificado, los datos basales no fueron similares en relación con la pérdida de sangre y la duración de la operación, aunque la nutrición enteral mostró un efecto tanto sobre el íleo como sobre la filtración anastomótica. Eso llevó a la conclusión, relacionada con la extensión de la inclusión de pacientes para la segunda hipótesis, de que la nutrición enteral reducía la filtración anastomótica, potenciada por alcanzar tamaños de muestra de 60 pacientes por grupo.
Análisis estadístico
Las variables fueron reflejadas como medias y/o medianas con error estándar de la media o rango intercuartilar (RIC). Las variables continuas fueron comparadas usando una prueba de t cuando estaban normalmente distribuidas o, en otro caso, usando la prueba U de Mann-Whitney. La prueba de 2 fue usada para la comparación de variables categóricas y fue efectuada la ANOVA de 2 vías para mediciones repetidas, para la comparación de tiempo entre grupos. La prueba de Kruskal-Wallis fue empleada para datos no paramétricos, cuando fue apropiado. Todos los datos fueron analizados usando el programa SPSS, versión 17.0 (SPSS Inc., Chicago, IL). Una P < 0,05 fue considerada significativa.
Resultados
Acrecencia de pacientes
Se reclutó un total de 123 pacientes. Sesenta y uno fueron randomizados para el grupo de NET y 62 para el grupo de NPT. Cinco pacientes se retiraron preoperatoriamente del grupo enteral, porque experimentaron molestias con la sonda de alimentación. En 2 pacientes del grupo enteral, la resección rectal no fue realizada por el hallazgo perioperatorio de metástasis intraperitoneales. Todos los análisis fueron efectuados de acuerdo al principio de intención de tratamiento. Las características basales y del tratamiento (tipo de cirugía, estadio y creación de ostomía) de los pacientes, estuvieron bien apareadas entre los 2 grupos del estudio (Tabla 1).
Nutrición
Las desviaciones del protocolo se describen en detalle en la Tabla 2 y debe remarcarse que hay más problemas con la administración de la nutrición enteral por sonda nasoyeyunal, que con la nutrición parenteral por vena central. El número total de desvíos fue de 34 en el grupo enteral, versus 13 en el grupo parenteral. Es importante ilustrar que en el grupo enteral, 17 pacientes no recibieron nutrición enteral 8 horas después de la cirugía, por las siguientes razones: 5 se retiraron del estudio, 2 fueron excluidos porque no fueron sometidos a resección rectal, en 2 no se colocó la sonda para la alimentación y 7 pacientes estaban hemodinámicamente inestables y la alimentación por sonda comenzó tardíamente.
• TABLA 2: Desviaciones del protocolo (primeros 5 días)
.png)
La información recolectada prospectivamente sobre la ingesta oral no reveló diferencias significativas entre los grupos. La cantidad de calorías de la ingesta nutricional artificial por día, durante los primeros 5 días, no fue significativamente diferente y la cantidad total e calorías en los primeros 5 días fue más baja en el grupo enteral que en el grupo parenteral (NET 5.187,5 ± 387,8 calorías/5 días vs NPT 6.814,1 ± 283,9 calorías/5 días; P < 0,005).
Función gastrointestinal
Con la excepción de 3 pacientes, todos los pacientes tuvieron una ostomía para la defecación (Tabla 1). La mayoría de los pacientes recibió una colostomía protectora a causa de una anastomosis muy baja, en combinación con una cirugía extensa y quimioradioterapia neoadyuvante o irradiación perioperatoria/re-irradiación en enfermedad recidivada. Dos de los pacientes que no tuvieron una ostomía estuvieron asignados en el grupo parenteral; desafortunadamente, ambos tuvieron un IPO y una filtración anastomótica, requiriendo reoperación y ostomía. La estadía hospitalaria de esos 2 pacientes fue de 15 días y 29 días, debido a infección profunda de la herida y después del egreso no hubo readmisión.
Un paciente (hombre, 39 años) que no tuvo una ostomía, estuvo asignado en el grupo enteral. Tuvo una reoperación por isquemia del asa aferente de la anastomosis; el colon descendente fue resecado y se confeccionó una ostomía. Postoperatoriamente, permaneció en la unidad de cuidados intensivos (UCI) por 2 días y desarrolló un IPO. La nutrición parenteral fue administrada por 7 días mientras estuvo en el grupo enteral y dejó el hospital en buenas condiciones en 17 días; no requirió readmisión.
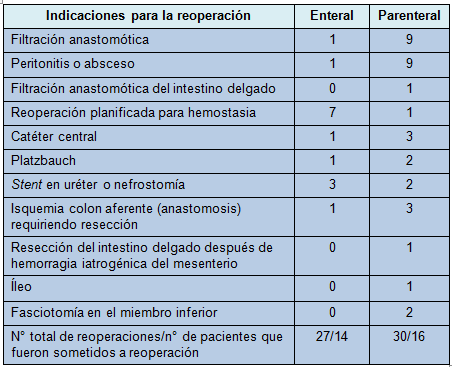
Un tiempo más breve hasta la primera defecación fue visto en el grupo enteral, comparado con el parenteral, durante los primeros 5 días (P = 0,04). En el grupo enteral, 54% (33/61) desarrolló un IPO versus 68% (42/62) en el grupo parenteral (P = 0,12). El íleo temprano ocurrió en 10 pacientes en el grupo enteral versus 22 en el grupo parenteral (P = 0,02). No se vieron diferencias para los íleos tardío y prolongado.
Complicaciones infecciosas
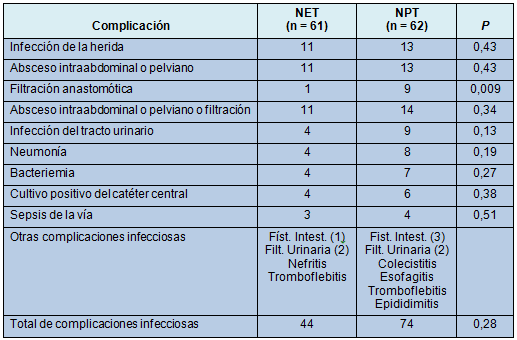
Después de la intervención enteral, sólo 1 paciente tuvo una filtración anastomótica, versus 9 pacientes en el grupo parenteral (P < 0,009); todos sometidos a reparación quirúrgica (Tabla 3). Asimismo, todos los pacientes con filtración anastomótica tuvieron también abscesos intraabdominales o pelvianos, algunos de los cuales pudieron manejarse con drenaje percutáneo. Otras complicaciones infecciosas no fueron significativamente diferentes (Tabla 4).
• TABLA 3: Indicaciones para las reoperaciones
• TABLA 4: Complicaciones infecciosas
A nivel basal, los niveles de proteína C reactiva (PCR) no fueron diferentes entre ambos grupos, pero fueron más altos en el grupo enteral en el día 1 (P = 0,04). En el día 5, ambos grupos mostraron una PCR similar, con un descenso más distintivo en el grupo enteral.
Complicaciones quirúrgicas
Las complicaciones quirúrgicas fueron clasificadas de acuerdo con Clavien y col. [7]. En el grupo enteral, 14 pacientes fueron sometidos a 27 reoperaciones, versus 16 pacientes en el grupo parenteral, que fueron sometidos a 30 reoperaciones (P = 0,71). En el grupo enteral, los procedimientos más primarios fueron suspendidos temporariamente para obtener hemostasia mediante empacamiento pelviano (n = 7), versus 1 en el grupo parenteral. Esos pacientes tuvieron reoperaciones planificadas dentro de los siguientes días, a veces para completar una resección, así como para efectuar una anastomosis. Esas reoperaciones aumentaron el número de reoperaciones en el grupo enteral. En el grupo parenteral, se realizaron más reoperaciones para exploración por sepsis aguda (Tabla 3).
No se hallaron diferencias significativas cuando se usó la clasificación de las complicaciones quirúrgicas descrita por Clavien y col [7].
Duración de la estadía en UCI, la estadía hospitalaria y readmisiones
La duración de la estadía (DE) en la UCI no fue diferente entre los grupos (NET 2,4 ± 0,8 días vs NPT 3,3 ± 1,5 días; P = 0,26).
La media de la DE en el hospital en donde se desempeñan los autores, fue de 13,8 ± 2,2 días para el grupo enteral vs 16,7 ± 2,3 días para el grupo parenteral (P = 0,007). En ambos grupos, los pacientes fueron transferidos a los hospitales derivantes cuando fue posible (NET 33% vs NPT 24%, P = 0,29).
El total de la DE, DE en el hospital y DE en los hospitales derivantes, no fue significativamente diferente entre los grupos (NET 17,4 ± 2,4 días vs TPN 22,4 ± 3,4 días; P = 0,15).
No se vio diferencia para la rehospitalización entre ambos grupos (NET, n = 14 vs NPT, n = 13; P = 0,87).
Discusión
En este ensayo clínico controlado y randomizado, el tiempo hasta la primera defecación, fue más corto después de la NET luego de cirugía rectal por enfermedad maligna. Importantemente, la NET se asoció con una ocurrencia más baja de filtración anastomótica y reducción de la estadía hospitalaria. Ambas rutas de alimentación tuvieron problemas específicos.
La nutrición enteral se asoció con frecuente desplazamiento de las sondas nasoyeyunales y las complicaciones infecciosas fueron significativamente mayores en el grupo parenteral. Debe mencionarse que la ingesta oral en los primeros 5 días fue comparable entre los grupos.
El grupo enteral recibió menos calorías de la nutrición artificial que el grupo parenteral, asociado probablemente con los frecuentes desvíos del protocolo encontrados en el grupo enteral. Se desconoce si los efectos observados pueden ser atribuidos a la ingesta calórica. Además, la NET fue segura y las complicaciones perjudiciales previamente reportadas, tales como la isquemia de intestino delgado o la neumonía aspirativa, no fueron observadas [8,9].
Los efectos beneficiosos de la NET sobre el IPO y la filtración anastomótica en este estudio fueron remarcables y nuevos. Los mismos pueden ser explicados por un efecto sobre la inflamación local. El íleo postoperatorio es disparado por la manipulación de los intestinos durante la cirugía [5]. En este estudio, la PCR fue inmediatamente más elevada después de la operación y se recuperó mejor después de la nutrición enteral, en comparación con el grupo de control.
Se considera que los mecanismos de fondo incluyen el hecho de que la manipulación del intestino inicia una cascada inflamatoria comenzando con la activación y desgranulación de los mastocitos y la activación de los macrófagos, llevando a la invasión de neutrófilos. Ello deteriora directamente la contractilidad de las células del músculo liso intestinal por medio de la liberación de óxido nítrico y prostaglandinas [5,10].
La formación de un infiltrado inflamatorio no sólo deteriora la motilidad en las áreas manipuladas, sino que también conduce a la hipomotilidad generalizada del tracto gastrointestinal, por medio de la activación de vías neurales adrenérgicas inhibitorias. La inhibición de la respuesta inflamatoria ha demostrado ser importante para reducir el IPO [11]. La nutrición enteral puede también reducir la respuesta inflamatoria y, por lo tanto, reducir el IPO [10,12]. La amortiguación temprana de esa inflamación, mediante la nutrición post-pilórica, puede explicar los resultados hallados.
En relación con la filtración anastomótica, la respuesta inflamatoria local es también importante. Se sabe que el factor alfa de necrosis tumoral modula la barrera epitelial en el intestino y puede también actuar como un factor inhibitorio en el proceso de cicatrización de la anastomosis intestinal, llevando a un aumento en la filtración anastomótica [13]. Además de la respuesta inflamatoria, las metaloproteinasas de matriz (MMP) tales como MMP-9, son también importantes en la cicatrización anastomótica y el IPO [14]. Esta hipótesis sobre los mecanismos de fondo no fue investigada en este estudio.
Este estudio está limitado de varias maneras. No hubo estudios previos a los que recurrir para el cálculo del tamaño de la muestra. Retrospectivamente, los días hasta la primera defecación fueron extraídos de los registros de los pacientes. Dado que eso pudo no haber sido completamente confiable, se planificó un análisis interino a n = 60. Ese análisis reveló más pérdida de sangre, mayor duración de la operación y menos filtración anastomótica en el grupo con nutrición enteral. Para descartar los efectos al azar y la relevancia clínica del posible efecto beneficioso de la nutrición enteral, fue el estímulo para recalcular el tamaño de la muestra para alcanzar poder estadístico sobre la filtración anastomótica como un objetivo final secundario.
Otro punto de énfasis es que la población de pacientes fue sometida a una cirugía rectal extensa y al menos la mitad de ellos requirió resección extramesorrectal y/o resección de órganos adyacentes, implicando un severo trauma quirúrgico, con pérdida concomitante de sangre y resucitación con líquidos. Por lo tanto, los resultados de este estudio pueden no ser comparables con otros estudios investigado la NET, en pacientes que son sometidos a cirugía colorrectal menos extendida.
Casi todos los pacientes en este estudio tuvieron una ostomía de protección o permanente, a causa del tratamiento neoadyuvante, radioterapia intraoperatoria y/o anastomosis coloanal baja. Una ventaja del diseño de este estudio fue que el tiempo hasta la defecación podía ser monitoreado exactamente, como un objetivo final sustituto del IPO. Podría sugerirse que los beneficios de la NET, en pacientes sometidos a cirugía gastrointestinal mayor, pueden extrapolarse a los pacientes sin ostomía; por supuesto que son necesarios nuevos estudios para comprobar esa hipótesis. Los pacientes en los programas de cirugía de vía rápida no son comprables con la población de pacientes de este estudio.
Aunque los autores no hallaron diferencias en las características basales (n = 123), el grupo enteral pudo haber sido quirúrgicamente más desafiante que el grupo parenteral. Para señalar: el grupo enteral fue mejor en varios puntos mencionados. Con respecto a las diferencias no significativas, los pacientes en el grupo enteral fueron operados más frecuentemente por enfermedad recidivada y recibieron más a menudo irradiación intraoperatoria. Los pacientes en el grupo enteral tuvieron un pérdida estimada de sangre levemente mayor (1.498 mL vs 1.200 mL parenteral; P = 0,15, n = 123) y 7 pacientes en el grupo enteral necesitaron 1 o más reoperaciones relacionadas con la hemostasia, en comparación con sólo 1 paciente en el grupo parenteral. La PCR en el día 1 fue más alta en el grupo enteral en comparación con el grupo parenteral, sugiriendo un trauma quirúrgico mayor (datos no mostrados).
Las reoperaciones planificadas para hemostasia, fueron incluidas en el análisis de la clasificación de Clavien-Dindo de las complicaciones quirúrgicas, lo que podría explicar porqué no se vieron diferencias. Existe diferencia en los pacientes sometidos a reoperaciones planificadas para hemostasia en el grupo enteral, comparado con las reoperaciones agudas por filtración anastomótica en el grupo parenteral; no obstante, la clasificación de Clavien-Dindo no distingue esas diferencias.
Otra limitación posible es que los autores eligieron comparar la ruta enteral con la ruta parenteral, para asegurar la equivalencia calórica entre los grupos y la ruta enteral de alimentación fue vulnerable para los desvíos del protocolo. Los desplazamientos o la remoción accidental de la sonda de alimentación ocurrieron frecuentemente (n = 11) y los problemas con la colocación se hallaron en 6 pacientes. Además, para evitar la isquemia del intestino delgado, la nutrición enteral no se comenzó temprano en los pacientes hemodinámicamente inestables.
En conjunto, eso resultó en menos de la cantidad total de provisión de la nutrición enteral en el grupo enteral, comparado con la nutrición parenteral en el grupo parenteral. Por lo tanto, surge la cuestión de si se subalimentó al grupo enteral. La cuestión es si la posible “subalimentación” en ese caso es peligrosa o beneficiosa. Los resultados de este estudio concuerdan con los resultados de alimentación en los pacientes en la UCI que, recibiendo cantidades más bajas de alimento, se recuperaron mejor que aquellos con las cantidades más altas permitidas de calorías [15]. Parece que la cantidad de calorías no es tan importante como la ruta y el momento de la nutrición artificial.
El diseño de estudio de comparar la NET versus sólo la nutrición estándar, en lugar de la nutrición parenteral, fue parte de la discusión en la fase de diseño y no fue elegido para la población de pacientes, debido a las fallas conocidas para progresar a una dieta normal y a que el indicador clave “mala nutrición”, en Holanda, obliga a alcanzar las metas calóricas en los primeros 5 días postoperatorios en la población con alto riesgo.
La opinión contraria podría ser que las metas de energía y proteínas, establecidas por las sociedades de nutrición, deberían ser vistas en perspectiva, especialmente cuando la alimentación parenteral es usada tempranamente, para obtener objetivos calóricos en la fase temprana del postoperatorio. El rol de los suplementos tempranos parenterales, en pacientes en donde los objetivos calóricos no pueden ser alcanzados por la ruta oral o enteral, es materia de disputa.
Varios meta-análisis estuvieron a favor de la nutrición parenteral en ciertas poblaciones de pacientes. Por ejemplo, Simpson y Doig [16], mostraron una tasa reducida de mortalidad, después de la nutrición parenteral, en un población bajo cuidados intensivos. Pacientes desnutridos con una dieta oral estándar, tienen un riesgo más alto de mortalidad que los pacientes que reciben nutrición parenteral [17]. Estudios adicionales comparando alimentación enteral vs parenteral estuvieron a favor de la nutrición enteral, describiendo menos complicaciones infecciosas y acortamiento de la duración de las estadías hospitalarias [17].
Recientemente, un estudio multicéntrico grande concluyó en que el uso de nutrición parenteral temprana o tardía puede brindar calorías y proteínas mejor que la alimentación enteral [18]. Sin embargo, sus pacientes en UCI, en los grupos parenterales, tuvieron un resultado clínico peor en relación con la mortalidad y con el egreso de la UCI [18]. En los pacientes en UCI, la iniciación tardía de la nutrición parenteral como un suplemento para una nutrición enteral insuficiente, se asoció con un mejor resultado clínico en comparación con la NPT [19].
Podría también concluirse de los resultados del presente estudio, que los suplementos parenterales tempranos no son un control seguro o incluso la cuestión de si el grupo control estuvo en desventaja al dársele NPT.
Los pacientes en el grupo enteral recibieron significativamente menos nutrición suplementaria pero anduvieron mejor en términos de filtración anastomótica, menos íleos tempranos, primera defecación más rápida y DE más corta en el hospital. La ingesta oral en ambos grupos estuvo bien apareada y no anuló los resultados clínicos entre los grupos enteral y parenteral, sugiriendo un papel clave para la nutrición enteral.
En este estudio, la NET, combinada con una dieta normal, fue superior a la nutrición suplementaria parenteral y, por lo tanto, los autores proponen su uso y podrían sugerir un plan preoperatorio para la alimentación enteral post-pilórica en pacientes con alto riesgo de IPO.
♦ Comentario y resumen objetivo: Dr. Rodolfo D. Altrudi