El desgarro del epitelio pigmentario es una conocida complicación de la DMAE exudativa. Pueden producirse espontáneamente o después de diversos tratamientos como láser térmico, terapia fotodinámica (TFD) con verteporfin, inyección intravítreo de triamcinolona acetonido e inyección intravítreo de agente anti-factor de crecimiento endotelial vascular (FCEV) cono pegaptanib, bevacizumab y ranibizumab.
Sin embargo, pocos estudios de casos describen la presencia de desgarros del EPR asociados con NVC clásica provocada por DMAE, sin desprendimiento del epitelio pigmentario después de los tratamientos mencionados. En el presente estudio se evalúa la incidencia y resultados funcionales de desgarros de EPR después de inyección intravítreo de ranibizumab para el tratamiento de NVC clásica causada por DMAE. Estudios multicéntricos, aleatorizados, doble ciego han mostrado mejores resultados en el tratamiento de DMAE exudativa con ranibizumab que con TFD, por lo que se ha convertido en el tratamiento más utilizado para la DMAE exudativa.
Pacientes y métodos:
Estudio observacional de 72 pacientes consecutivos, tratados en el Hospital de Ojos Universitario Jules Gonin, en Lausana, con inyección intravítreo de ranibizumab 0,5 mg para tratar NVC clásica entre marzo 2006 y febrero 2008. Se comprobó la agudeza visual mejor corregida, se realizó examen de fondo de ojo y tomografía de coherencia óptica mensualmente y angiografía fluoresceínica en línea base y cada tres meses.
Paciente 1: Angiografía fluoresceínica y tomografía de coherencia óptica en línea base (A, B, C) y a los 6 meses del diagnóstico de desgarro del EPR (D, E, F). El tamaño del desgarro del EPR no aumentó durante estos 6 meses. Aunque el desgarro llegó muy cerca de la fóvea, la zona avascular foveal no estuvo en el EPR (cruz) lo que permitió una agudeza visual mejor corregida de 0,2 log MAR con tratamiento continuo de agente anti-factor de crecimiento endotelial vascular. La última angiografía antes del tratamiento (B) muestra actividad exudativa, que desaparece en la angiografía a los 6 meses del desgarro (E). Profundización en las señales de los coriocapilares despojados en la imagen de OCT señaladas con flechas (F).
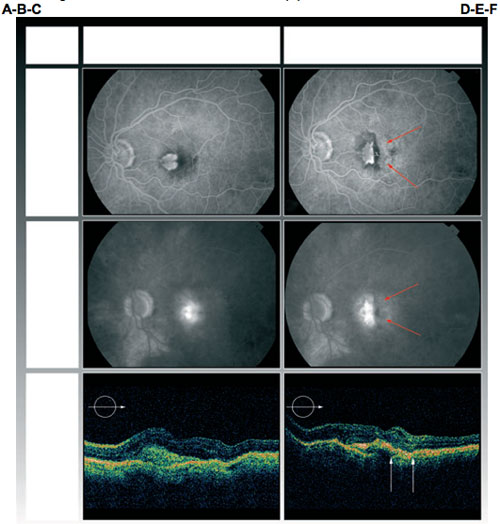
Paciente 2: Angiografía fluoresceínica y tomografía de coherencia óptica en línea base (A, B, C) y en el seguimiento final a los 6 meses del desgarro del EPR (D, E, F). El tamaño del desgarro se mantuvo estable y la fovea no entró dentro del área despojada del EPR (D, E) lo que permitió una agudeza visual mejor corregida de 0,1 log MAR con el tratamiento contínuo de agente de anti-factor de crecimiento endotelial vascular. La cruz muestra la ubicación de la fóvea y las flechas los límites del desgarro (D,E). La actividad exudativa fue poca aún antes del tratamiento (B), y no se observa en la última angiografía (E). La TCO muestra el área despojada del EPR (coriocapilares hiperreflectivos entre flechas con señal de profundización).
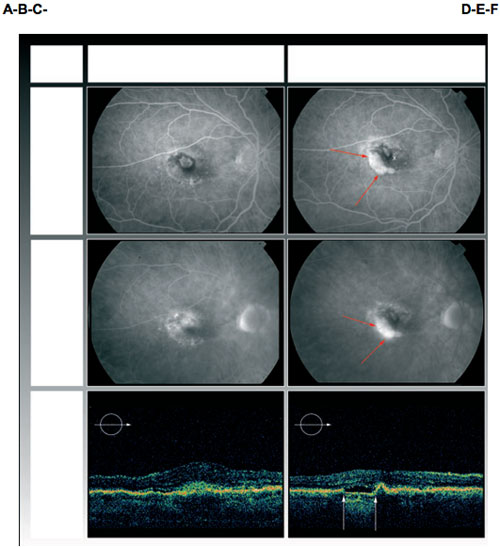
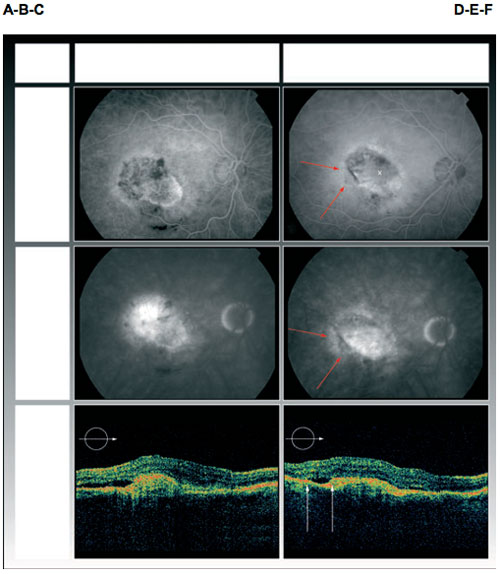
Paciente 3: Angiografía fluoresceínica y tomografía de coherencia óptica en línea base (A, B, C) y a los 8 meses del diagnóstico de desgarro del EPR (D, E, F). La cruz indica la ubicación de la fóvea y las flechas los límites del desgarro (D,E). La agudeza visual mejor corregida mejoró con el tratamiento de agente anti-factor de crecimiento endotelial vascular, de 0,3 log MAR a 0,1 log MAR. La TCO no muestra límites definidos del desgarro. Por superposición de la línea de TCO con el angiograma, el desgarro puede ubicarse bajo el área de fluido subretiniano (F). La última angiografía (B-E) muestra reducción de la actividad exudativa, que también es visible en la TCO (C-F).
El presente estudio muestra claramente que pueden desarrollarse desgarros del EPR en ojos con NVC clásica, aún sin DEP, después del tratamiento con anti-FCEV. A nuestro entender, se trata del primer informe sobre la incidencia de esta complicación asociada con inyecciones intravítreo de ranibizumab en ojos con NVC clásica sin DEP. Es sorprendente que no se hayan informado casos de desgarro del EPR en el estudio ANCHOR, que incluyó 290 pacientes con NVC clásica tratados con ranibizumab (Brown et al. 2006).
Como era de esperar, los resultados muestran que la incidencia de desgarros después de inyecciones de ranibizumab en ojos con NVC clásica es mucho más baja que en ojos con DEP vascularizado (5,4% contra 12,3%). Todos los estudios muestran una incidencia más alta de desgarros del EPR que en estudios sobre la historia natural de la patología. Dados los resultados obtenidos es probable que la inyección de ranibizumab esté asociada con una tendencia menor a inducir desgarros del EPR en dichos ojos en relación con otros agentes anti-FCEV. De todas formas debe seguir investigándose esta hipótesis. Se han considerado diversos mecanismos, nosotros estamos a favor del mecanismo simple, independiente de la presencia o ausencia de DEP, es decir la inducción de fuerzas horizontales de la NVC contraída por los distintos métodos de tratamiento sobre la capa superior del EPR ya debilitada por los mecanismos de la DMAE. Asimismo, la observación de los desgarros del EPR en estos pacientes luego de un promedio de cuatro inyecciones de ranibizumab, implica un efecto acumulativo de las inyecciones que induce el desgarro del EPR. La contracción horizontal en aumento de la NVC puede ser inducida por las inyecciones reiteradas, provocando un aumento de la tensión en la capa del EPR. Suponemos que dicho efecto acumulativo estuvo presente en nuestros pacientes., incrementándose hasta el umbral necesario para provocar el desgarro del EPR,
Se ha considerado otro probable mecanismo de los desgarros que involucra el aumento del trasporte de fluidos en el espacio sub-EPR, en presencia de una membrana de Bruch hidrofóbica asociada con la DMAE. Sin embargo, este mecanismo tendría importancia solo en caso de DEP.
Los resultados funcionales después de desgarro del EPR varían ampliamente, independientemente de su causa. La ubicación de la fóvea y la dimensión de la exudación son relevantes para los resultados. En nuestros pacientes, al no verse comprometida la fóvea en los desgarros del EPR y reducirse la neovascularización con el tratamiento anti-FCEV, se logró recuperar visión a pesar de los desgarros. Por lo tanto, el desgarro del EPR en sí no es, necesariamente una contraindicación para seguir con el tratamiento anti-FCEV. No obstante, en teoría aumenta el riesgo de que se extienda el desgarro del EPR por la continua contracción de la NVC con el tratamiento.
Es de interés la observación en el presente estudio de la ubicación del desgarro del EPR temporal a la fóvea en todos los pacientes de la serie.
Como conclusión, los profesionales deben ser concientes del riesgo de desgarros del EPR después de inyecciones intravítreo de ranibizumab para tratar DMAE exudativa, aún en casos NVC clásica sin DEP. Sin embargo, es posible mejorar la visión con el tratamiento, a pesar del desgarro del EPR.
Conclusiones:
Pueden producirse desgarros del EPR después de inyecciones intravítreo con ranibizumab para tratar la NVC clásica en 5% de los pacientes, aun sin desprendimiento del EPR en línea base. No obstante, la visión puede mejorar siempre que la fóvea no esté comprometida.
♦ Síntesis y traducción: Dr. Martín Mocorrea, médico oftalmologo.
Bibliografía:
1 Brown DM, Kaiser PK, Michels M, Soubrane G, Heier JS, Kim RY, Sy JP & Schneider S (2006): Ranibizumab versus verteporfin for neovascular age-related macular degeneration. N Engl J Med 355: 1432–1444.
2 Cantrill HL, Ramsay RC & Knobloch WH (1983): Rips in the pigment epithelium. Arch Ophthalmol 101: 1074–1079.
3 Carvounis PE, Kopel AC & Benz MS (2007): Retinal pigment epithelium tears following ranibizumab for exudative age-related macular degeneration. Am J Ophthalmol 143: 504–505.
4 Casswell AG, Kohen D & Bird AC (1985): Retinal pigment epithelial detachments in the elderly: classification and outcome. Br J Ophthalmol 69: 397–403.
5 Chan CK, Meyer CH, Gross JG et al. (2007): Retinal pigment epithelial tears after intravitreal bevacizumab injection for neovascular age-related macular degeneration. Retina 27: 541–551.
6 Chang LK, Flaxel CJ, Lauer AK & Sarraf D (2007): RPE tears after pegaptanib treatment in age-related macular degeneration. Retina 27: 857–863.